Curso de reparador de equipos domésticos de refrigeración.
Centro de formación profesional N° 403 Sub Sede Morón.
Apuntes de inicio.
Al iniciar el estudio de cualquier disciplina uno tiene una
idea, un proyecto, una meta.
Todo conocimiento requiere el manejo de un determinado
lenguaje, en la rama técnica utilizamos
justamente el lenguaje técnico. Al comienzo resulta un poco complejo, como todo
lenguaje, pero es indispensable para poder abordar el estudio de la
refrigeración o cualquier oficio o labor.
Cotidianamente usamos un lenguaje, nos comunicamos con un
conjunto de palabras que nos permiten comprendernos día a día. Cuando nos
dedicamos al estudio de una tarea específica debemos reformular nuestro
vocabulario.
Nuestro curso consiste en generar, descubrir y desarrollar
juntos, herramientas que permitan reparar e instalar equipos frigoríficos de
uso doméstico.
Seguramente todos ustedes tienen una idea acerca de lo que
es la refrigeración, por eso han decidido estudiarla, seguro muchos de ustedes
vienen con un deseo de aprender un oficio, de poder tener una entrada económica
extra o simplemente estudiar por curiosidad.
¿Por dónde comenzamos entonces? ¿Es necesario dar una
definición? ¿Para qué sirve una definición?
Cuando definimos queremos explicar en qué consiste tal o
cual cosa, queremos que quede claro aquello que estamos estudiando, para ello
debemos ser rigurosos con las palabras que utilizaremos para que no queden
dudas acerca de lo que pretendemos explicar.
Hay palabras que utilizamos cotidianamente que tienen un
significado aproximado o impreciso, pero que es efectivo para comprendernos. En
una definición no puede existir duda acerca de lo que estamos hablando porque
esto nos conduciría a errores.
Pero… ¿Qué es la refrigeración? Intentaremos dar una
definición, pero al hacerlo utilizaremos palabras que deberán ser definidas
también, esto parecería no tener fin… Pero tenemos que empezar por algún lado,
y es necesario hacerlo por el principio…
Tal vez un buen principio sea empezar por los “ladrillos”
con los cuales está formado todo:
El átomo: Seguramente muchos de ustedes han escuchado, leído o
estudiado alguna vez el concepto de átomo. Su palabra proviene del latín
atomun y éste del griego que significa “indivisible” o sea que no puede ser
dividido. Todas las “cosas” están constituidas por estos átomos, porciones
elementales de todo aquello que forma parte del universo. Los científicos
han desarrollado una gran cantidad de teorías para explicar que aspecto tienen
dichos átomos en su forma íntima, para nosotros es suficiente saber
que los átomos se combinan para formar “moléculas” y estás moléculas
son las que determinan “la masa” de las “cosas”, o sea, la
“cantidad de materia que posee una sustancia.
En resumen: todo está constituido por átomos: una silla, una
nube, un mosquito, un pedazo de pan, nosotros, etc. Estos átomos “se juntan”
para formar moléculas, todas las moléculas dan “forma” a las sustancias,
la masa
es la cantidad de materia (moléculas) que posee dicha
sustancia.
Por ejemplo el agua, sustancia maravillosa que permite la
vida tal como la conocemos en el planeta tierra, está formada por dos
átomos
de hidrógeno y un átomo de oxígeno.
Esto último se escribe de esta manera: una molécula de H₂O₁ H: hidrógeno; O: Oxígeno
Fíjense que los subíndices (numeritos debajo de las letras)
indican la cantidad de átomos o sea 2 para el hidrógeno y uno para el oxígeno.
Cuando el átomo es uno solo no se pone subíndice o sea: H₂O: Sustancia agua,
componentes: 2 átomos de hidrógeno más 1 átomo de oxígeno.
Los científicos utilizan letras y números para dar nombre a
los átomos y moléculas de las sustancias, esta ciencia se llama química.
Nosotros en refrigeración, por ejemplo, estudiaremos los “refrigerantes” y sus fórmulas
químicas correspondientes
Sistema: Entendemos por sistema a una porción del universo
que tomaremos para poder estudiarlo. Por ejemplo podemos tomar una
muestra de aceite de un motor para analizar sus propiedades como viscosidad,
acidez, humedad, etc. También podemos hablar de cómo se comporta un
refrigerante dentro de un sistema frigorífico: su volumen, su presión, su
temperatura, etc.
Desde tiempos antiguos el ser humano necesitó establecer un
sistema de medición, seguramente por cuestiones prácticas de división de
terrenos para sembrar, para el comercio, la construcción, etc. Pero: ¿Qué
hacemos cuando medimos?
Medir es comparar una unidad con otra tomada como patrón.
Los pueblos antiguos inventaban su unidad patrón tomando
como referencia ciertas partes del cuerpo del monarca del país; por ejemplo, el
pie, la pulgada, el codo, etc. Actualmente muchas de estas unidades se siguen
utilizando en el sistema de medidas inglés.
Esto trajo un gran problema con el paso del tiempo ya que se
dificultaba la comunicación entre pueblos y ciudades de un mismo país, y los
trabajos entre científicos y técnicos muchas veces no podían realizarse ya que
era difícil ponerse de acuerdo en la elección de una unidad conveniente.
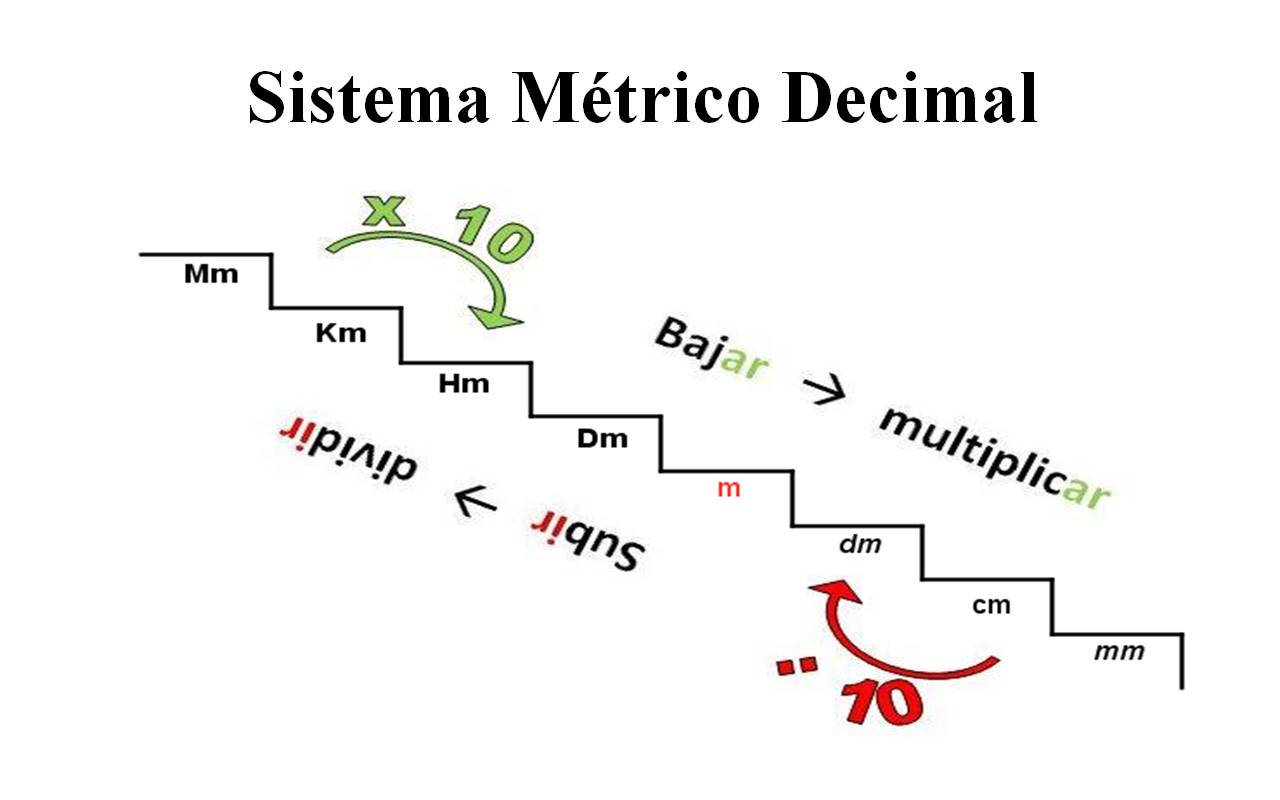
Sistema Métrico Decimal.
Los inconvenientes que acabamos de señalar llevaron a
algunos científicos de los siglos XVII y XVIII a proponer unidades de medida
definidas con mayor rigor y que se adoptarían en forma universal. Las diversas
propuestas, aunque no tuvieron aceptación inmediata, acabaron por dar lugar al
establecimiento del llamado Sistema Métrico Decimal, en Francia. La firma del
decreto del 7 de abril de 1795, que
instauró este sistema, constituyó una de las contribuciones más significativas
de la Revolución Francesa.
Las principales características del sistema de unidades que
se propuso, son:
1)
Como su nombre lo indica, el sistema es decimal.
2)
Los prefijos de los múltiplos y submúltiplos se
eligieron de modo racional, empleándose palabras griegas y latinas (kilo: 1000,
mili: 0,001, deca: 10, deci: 0,1, etc.) para designarlos.
3)
La tierra se tomó como base para escoger la
unidad de longitud: el metro se definió como la diezmillonésima parte
(0,0000001) de la distancia del ecuador al polo norte. Esta cantidad se marcó
sobre una barra de platino iridiado llamado metro patrón que todavía se
conserva en un archivo oficial de pesos y medidas en París.
En 1840 una ley declaró en
Francia ilegal el uso de cualquier unidad que no perteneciera al sistema
métrico, quedando así implantado definitivamente en Francia el nuevo sistema.
Por esa misma época, el sistema
métrico decimal ya se empezaba a conocer en otros países, y en 1875 se efectuó
en París la célebre Convención del Metro, en la que 18 naciones se
comprometieron a adoptarlo. Inglaterra no asistió a dicha reunión, negándose a
emplear las unidades de este sistema.
En refrigeración la mayoría de
las unidades figuran en el sistema de medición inglés, tanto en los equipos,
catálogos y textos, por eso es importante saber pasar de un sistema a otro sin
dificultades.
Sistema Internacional de
Unidades. (S.I)
Desde entonces, el uso del
sistema métrico se fue extendiendo poco a poco en todo el mundo. Nuevas
unidades para medir otras magnitudes, conservando las mismas características
que se emplearon en la definición del metro, fueron incorporándose al sistema.
Por otra parte, la precisión de los patrones establecidos en el siglo XIX no
bastaba en el gran avance científico del siglo XX. Así que los científicos advirtieron
la necesidad de una reestructuración del sistema métrico, y en 1960, durante la
11ª Conferencia General de Pesas y Medidas, también llevada a cabo en París, se
elaboró un nuevo sistema denominado Sistema Internacional de Unidades: S.I
Debemos observar que el S.I se
basa en el original sistema métrico decimal, pero sus unidades están definidas
de manera más rigurosa y actualizada.
La cuarta definición dada en la
17. ª Conferencia General de la Oficina Internacional de Pesos y Medidas es la
siguiente:
Un metro es la distancia que
recorre la luz en el vacío durante un intervalo de 1/299 792 458 de segundo.
La precisión de esta definición
es treinta veces superior a la del prototipo de 1960.
Para poder pasar de unidades tenemos que recordar la siguiente regla:
En la Tabla 1 se muestran las siete magnitudes principales del Sistema Internacional de Unidades, ellas son las bases en las cuales se construyen todas las demás unidades derivadas.





